Gastrite da Helicobacter Pylori: come riconoscerla e curarla?
L’Helicobacter pylori è un batterio Gram-negativo di forma elicoidale flagellato, acido-tollerante, isolato per la prima volta nel 1983 dagli scienziati Robin Warren e Barry Marshall, che si annida nelle cellule della mucosa gastrica.
La resistenza a PH compreso fra 1 e 2 gli è conferita dalla produzione dell’enzima ureasi, un enzima che idrolizza l’urea con rilascio di ammonio, che neutralizza l’acidità gastrica e crea intorno al batterio un microambiente compatibile con la sua esistenza.
L’incidenza dell’infezione varia a seconda dell’area geografica e delle condizioni socio-economiche: è meno frequente nei Paesi sviluppati, mentre raggiunge percentuali altissime di diffusione nei Paesi poveri. In Italia la prevalenza media di infezione negli adulti è stimata di circa il 60%.
L’H.pylori infetta solamente l’uomo e si trasmette per via oro-orale o oro-fecale, pertanto l’unica possibilità di prevenzione sta nel rispetto delle norme igieniche.
Sintomatologia e diagnosi
I pazienti affetti da “gastrite da H.pylori” possono lamentare sintomatologia dispeptica, con dolore o “fastidio” localizzato ai quadranti addominali superiori, nausea, vomito, inappetenza; molti pazienti però possono anche essere completamente asintomatici.
La diagnosi dell’infezione da H.pylori può essere effettuata mediante test non invasivi (breath test e test dell’Ag fecale) e di test invasivi, cioè durante EGDS utilizzando campioni bioptici su cui eseguire test rapido all’ureasi o una colorazione istologica.
Avere l’H.pylori non è però sinonimo di malattia: alcuni soggetti possono infatti ospitare il batterio senza sviluppare patologia né avere disturbi, altri invece sono destinati ad ammalarsi di gastrite o di ulcera peptica.
Gli effetti dell’infezione da Helicobacter Pylory
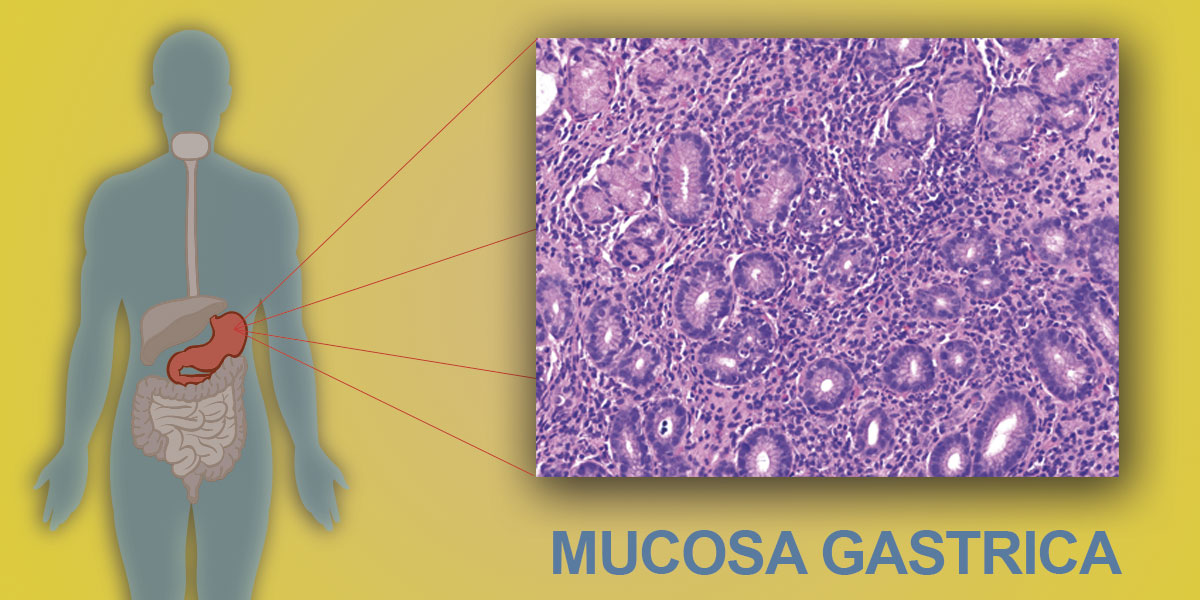
La gastrite è definita come un processo infiammatorio, acuto o cronico, della mucosa gastrica.
La durata dell’infiammazione può essere usata per differenziare la condizione acuta da quella cronica. L’H.pylori è l’agente eziologico più comune.
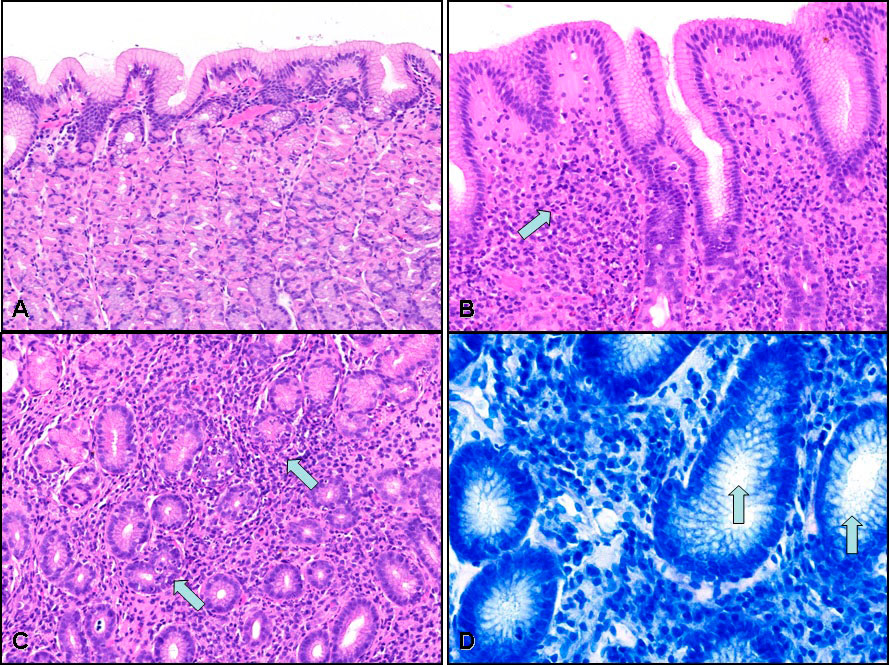
La maggior parte dei pazienti infettati da H.pylori sviluppa una gastrite acuta, che si può risolvere spontaneamente. L’infezione acuta è associata allo sviluppo di ipocloridria ed infiltrazione neutrofila alle biopsie gastriche.
Dopo un’infezione acuta, la maggior parte delle gastriti acute evolve in gastriti croniche che, istologicamente, sono caratterizzate da infiltrazione di cellule mononucleari, in prevalenza linfociti, plasmacellule e macrofagi.
In un’infezione da H.pylori, frequentemente vengono riscontrati follicoli linfoidi con centri germinali.Gli effetti dell’infezione da H.pylori variano a seconda della localizzazione nello stomaco:
– l’infezione a predominanza antrale si traduce in un aumento di produzione di gastrina e la conseguente ipersecrezione di acido predispone all’ulcera pre-pilorica ed all’ulcera duodenale;
– l’infezione a predominanza del corpo causa atrofia gastrica e ridotta produzione di acido con conseguente predisposizione a sviluppare ulcera gastrica, metaplasia e adenocarcinoma gastrico. L’infezione da H.pylori è quindi associata allo sviluppo di lesioni precancerose come la gastrite atrofica, la metaplasia gastrica intestinale, la displasia e l’adenocarcinoma, in particolare di tipo intestinale.
Classificazione e trattamento
La classificazione di Sydney classifica le gastriti secondo la topografia (pangastrite, gastrite di antro o di corpo), la tipologia (eritematosa/essudativa, atrofica, erosioni rilevate o piatte, congestizia, emorragica) ed il grado di severità (assente, lieve moderata o severa). Questo sistema non fornisce indicazioni prognostiche utili alla routine diagnostica.
Nel 2005 fu proposto un nuovo un sistema di stadiazione (OLGA system) che, attraverso la valutazione del grado e dell’estensione dell’atrofia, permette l’identificazione di un sottogruppo di pazienti con lesioni precancerose a più alto rischio che richiedono una strategia di sorveglianza.
Il trattamento dell’infezione da H.pylori si avvale dell’utilizzo di antibiotici associati ad un inibitore di pompa.
La triplice terapia (PPI+ claritromicina + amoxicillina) somministrata per 14 giorni è il regime più frequentemente prescritto.
Tuttavia, in molte regioni del mondo, il tasso di resistenza alla claritromicina è aumentato, per cui la quadruplice terapia (PPI+ bismuto+ eritromicina+ metronodazolo) è la migliore terapia iniziale in queste aree.
Dr.ssa Carolina Aronne, Gastroenterologia ed Endoscopia digestiva, Ospedale MultiMedica, Castellanza.
Dr. Andrea Ferretti, Specialista in Anatomia Patologica, Polo Scientifico e Tecnologico MultiMedica.